식약처 허가를 받지 않은 제품, 임상시험용의약품 사용 목적의 수입 통관 절차는?
2016년 자주묻는 질문집 Q44.
식약처 허가를 받지 않은 제품, 임상시험용의약품 사용 목적의 수입 통관 절차는?
위약을 사용한 임상시험을 진행할 예정인데, 사용예정인 위약이 현재까지 식약처 허가를 받았던 적이 없었던 것으로 알고 있습니다. 또한 이 위약은 수입이 되어야 하며 허가받지 않았던 위약이 통관 시에 문제가 없는지에 대해
① 식약처 허가를 받지 않았던 위약을 수입할 경우에는 어떠한 절차가 필요한가요?
② 식약처에서 해당 임상시험 계획서를 승인받은 후, 수입요건면제 확인 추천서를 신청하면 위약의 수입에 있어서 문제가 없는지요?
식약처 답변
수행하시고자 하는 임상시험이 식품의약품안전처장의 승인 대상인 경우에는 한국의약품수출입협회장에게 임상시험계획승인서 등 아래의 자료를 첨부하여 전자문서 교환방식에 의한 표준통관예정보고를 필한 후 수입할 수 있습니다.
- 사업자등록증 1부
- 임상시험계획승인서(공문포함)
- Invoice
- 임상시험계획서 중 수입하고자 하는 시험약의 용량을 확인할 수 있는 자료
참고로, 임상시험계획승인서가 없는 식품의약품안전처장의 승인 제외 대상 임상시험인 경우에는 아래의 자료를 우리 처(임상제도과)에 제출하면 임상시험용 의약품 확인 공문을 발부하여 드리고 있으며, 임상시험계획승인서 대신 동 공문을 첨부하여 식품의약품안전처장의 승인 대상 임상시험과 동일한 절차로 수입할 수 있습니다.
- 4상 임상시험용 의약품 통관 요청서(업체 공문 형식)
- 임상시험실시기관의 IRB 승인서
- 임상시험계획서 요약
- 수입예정인 임상시험용 의약품 정보(수입자, 제품명, 제조원, 수입예정량, 수입예정기간, 수입세관 등)
보다 자세한 절차는 한국의약품수출입협회로 문의하시면 됩니다.
※ 약사법제34조(임상시험등의 계획 승인 등)
CR러너's comments
임상시험용의약품을 수입하고자 하는 자는 식약처장의 임상시험계획승인을 받아야 하며, 매 수입 시마다 한국의약품 수출입협회장에게 전자무역문서로 표준통관예정보고를 신청하여 요건확인을 받고 수입 통관하여야 합니다.
※ 임상시험용의약품 수입절차
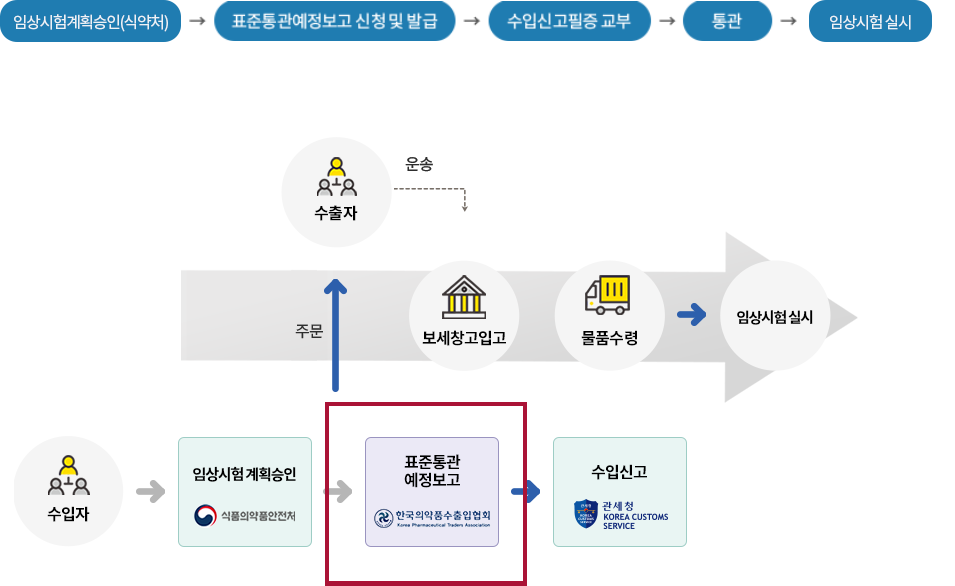
※ 수입자 자격요건
임상시험계획승인을 받은 자
☞ 임상시험계획승인을 받은 자의 의뢰를 받아 타사(CRO 등)가 수입하는 경우, 임상시험계획승인을 받은 자와 타사의 수입업무위수탁체결서 제출
※ 표준통관예정보고서 신청방법

통관단일창구(EDI Web Provider): 3군데 중 1군데 자유롭게 선택하여 신청 가능함
- 관세청 유니패스 (https://unipass.customs.go.kr/)
- 나연테크 임포트이디아이 (http://www.importedi.com)
- 레디코리아 헬프트레이드 (http://www.helptrade.net)
※ 구비서류
| 수입자 | 구비서류 (원본 제출인 경우만 별도 표시) |
| 임상시험계획승인을 받은 자 | 최초 수입시 - 사업자등록증 - 임상시험계획승인공문 - 임상시험계획승인서(IND) (*IRB승인서 받은 경우 대체 가능) - 프로토콜 내 기타 해당약 사용한다는 내용 확인 가능한 페이지 1부 - 제조원을 확인할 수 있는 서류 - 수입대행 또는 위수탁계약서 (해당하는 경우) 반복 수입시 - 기수입실적이 있음을 증명할 수 있는 서류 (직전 승인 내역 등) - 수입 관련 무역 제반 서류 (필요한 경우) |

관련규정
통합공고 제2장제1절 (의약품등의 수출입)
제33조의2(임상시험용 의약품등, 의료기기 및 체외진단의료기기의 통관) ① 의약품 등의 안전에 관한 규칙 제7조 및 제57조에 따라 임상시험을 목적으로 수입하는 임상시험용의약품 등(원료, 대조약, 위약 포함)을 수입하고자 하는 자는 의약품 등의 안전에 관한 규칙 제24조제7항에 따른 임상시험계획승인서 사본 또는 같은 규칙 제28조제5항에 따른 임상시험용의약품의 치료목적 사용승인서 사본(치료목적사용을 위해 수입하는 경우에 한함)을 제출하고 통관하여야 한다. 다만, 마약 및 향정신성의약품에 대하여는 식품의약품안전처장의 수입요건확인을 받은 후 통관하여야 한다.
② 의료기기법 제10조제2항의 규정에 의거 임상시험용 의료기기를 수입하고자 하는 자는 의료기기법 시행규칙 제20조제4항에 따른 임상시험계획승인서 사본, 체외진단의료기기법 제4조 및 제7조에 따른 임상적 성능시험용 체외진단의료기기를 수입하고자 하는 자는 체외진단의료기기법 시행규칙 제13조제4항·제6항에 따른 임상적성능시험계획승인서 사본을 식품의약품안전처장이 지정·공고하는 요건확인기관의 장에게 제출하고 전자문서교환방식 등에 의한 수입요건확인면제를 필한 후 통관하여야 한다. 다만, 의약품 임상시험에 사용되는 의료기기, 체외진단의료기기의 경우 의약품 등의 안전에 관한 규칙 제24조제7항에 따른 임상시험계획승인서 사본 또는 임상시험심사위원회 승인서(의약품 임상시험계획승인 면제대상에 한함)를 지방식품의약품안전청에 제출하고 「의료기기법 시행규칙」제32조 및 「의료기기 수입요건확인 면제 등에 관한 규정」에 따라 ‘의료기기 요건면제확인 추천서’를 식품의약품안전처장이 지정·공고하는 요건확인기관의 장에게 제출하고 전자문서교환방식 등에 의한 수입요건확인면제를 필한 후 통관하여야 한다.
제34조(의약품 등의 검정)
① 의약품등(원료의약품, 인체세포등, 화장품 및 그 원료 제외)을 수입한 자는 검정을 필한 후 이를 판매하거나 양도 또는 사용하여야 한다. 다만, 식품의약품안전처장이 정한 "수입의약품등관리규정"에 의한 검정 또는 검사 면제대상의약품 등과 임상시험용의 경우에는 검정 또는 검사를 면제한다.
제35조(의약품등, 의료기기, 체외진단의료기기 및 화장품의 수입)
⑦ 의약품 등은 전자문서교환방식에 의한 표준통관예정보고서에 수입자, 위탁자, 원산지, 제조원, 총금액, HS부호, 품명(원료의약품의 경우에는 일반명 또는 화학명, 인체세포등의 경우에는 인체세포등 유형), 원료약품의 명칭ㆍ분량 및 규격(원료의약품의 경우에는 공정서, 수재품목인 경우 공정서 명칭등), 단위 및 수량, 단가, 금액, 제조번호 및 일자, 선적항 및 송화인, 결재기간 및 가격조건, 통관예정일자, 최초검정기관과 허가(신고)사항 [별표5(부속서란에 ○이 표시된 조수제외) 및 별표6의 야생 동·식물의 가공품을 함유하고 있는 경우 동·식품의 학명병기], 조건이행 확인사항, 식품의약품안전처장이 허가시 부여한 품목기준코드 등을 기재하여야 한다.(00-75호 개정) 이 경우 의약품 제조업자가 자신이 제조하는 의약품의 원료로 사용하기 위하여 직접 수입하는 원료의약품(주성분에 한함)은 동 원료의약품이 사용된 의약품의 품목기준코드를 기재하고 임상시험용의약품등(원료, 대조약, 위약포함)의 경우에는 그러하지 아니하다.
⑫ 반추동물 유래품목으로서 의약품등, 의료기기를 수입하고자 하는 자 및 화장품(원료)을 수입하여 유통ㆍ판매하려는 자는 EU지역산 특정위험물질 유래품목과 영국 및 북아일랜드산 소 유래물질(단, 젤라틴은 제외)을 함유 또는 사용한 품목은 수입을 하여서는 아니 되며, 상기 수입금지 대상품목이 아닌 것으로서 식품의약품안전처장이 지정한 국가산 반추동물 유래품목의 경우 표준통관예정보고시(기원동물의 학명, 동물유래성분명, 사용부위, 롯트번호 및 원산지를 기재) TSE(Transmissible Spongeform Encephalopathy, 전염성해면상뇌증) 감염 우려가 없다는 내용의 수출국 정부가 발급한 증명서 또는 공공기관이 발급한 증명서를 제출·확인받아야 하며, 동 반추동물 유래품목을 제3국을 경유하여 수입할 경우에는 표준통관예정보고시 TSE 감염 우려가 없다는 내용으로 당해 동물의 도살국 또는 당해품목 생산국의 정부 또는 공공기관에서 발급한 증명서 사본에 동 원료를 사용하여 제조되었다는 내용과 상기 수입금지 대상품목이 아니라는 내용으로 당해 품목의 제조사 책임자가 서명 하고 공증한 서류원본을 제출·확인 받아야 한다. 식품의약품안전처장이 지정한 국가 이외의 국가산 반추동물 유래품목의 경우는 당해 품목에 사용된 동물의 원산지를 증명할 수 있는 서류를 제출·확인 받아야 한다. (2001-83호 신설) 다만, 식품의약품안전처장이 지정한 국가의 품목으로서 반추동물 유래품목을 사용하지 않고 타동물이나 식물 또는 화학적 합성 등에 의한 의료기기 및 화장품을 수입하고자 하는 자는 동 내용을 입증하는 서류로서 제조사 책임자가 서명하고 공증한 서류 원본을 제출·확인 받아야 한다. 다만, 임상시험용 의료기기의 경우 요건면제 신청시 상기 BSE 관계 증명서류를 제출하여 확인 받아야 한다.
제38조(수출입 특례)
⑤ 식품의약품안전처장은 신약개발과 원료의약품의 국산화 촉진과 임상시험을 위한 목적에 사용되는 원료 물질, 원료의약품, 임상시험용 제조약(위약 포함)의 수입은 이 고시 제31조제1항 및 별표2의 품목별수입요령에도 불구하고 다음 서류를 갖추어 신청한 경우 개발 등에 필요한 최소량에 한하여 수입허가 할 수 있다. 이 경우 수입된 의약품등에 대하여는 식품의약품안전처장의 사후관리를 받아야 한다.
1. 수입허가 신청서 1부
2. 물품매도확약서 1부
3. 신청사유서 1부
4. 개발(국산화)계획서 또는 임상시험승인서 1부(00-75호 개정)
'자주 묻는 질의 응답 > 의약품임상시험 FAQ' 카테고리의 다른 글
| 시험자의 임상시험 실시경험 증빙자료 (0) | 2024.07.12 |
|---|---|
| 대조약으로 구매한 타사의 미사용 의약품을 다른 임상시험에 사용 가능한지? (0) | 2024.07.12 |
| 다국가임상시험인 경우, 안전성보고 종료 시기가 국내 기준인지? 국외 포함인지? (0) | 2024.07.10 |
| CRO가 IND holder인 경우, 실시기관의 장과 계약하는 주체는? (0) | 2024.07.09 |
| 임상시험계획 신청시, 임상시험용의약품의 안정성 시험 자료(사용기한) (0) | 2024.07.03 |




댓글