(품목) ㈜보령, 트루디피정15/30밀리그램(다파글리플로진, 피오글리타존) 등 2품목
임상시험실태조사 결과정보 리스트(2023.1.1 실태조사부터 공개 시작)

실태조사 결과
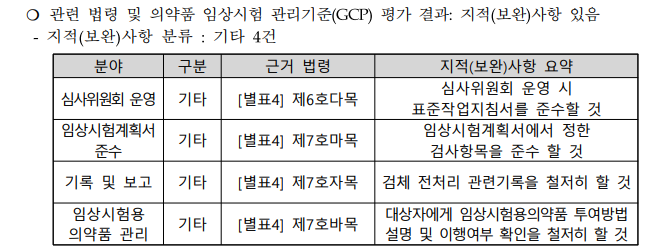

관련 법령
[별표4] KGCP 제6호다목
다. 심사위원회의 운영
심사위원회는 심사위원회 운영 시 실시기관 표준작업지침서를 준수하여야 한다.
[별표4] KGCP 제7호마목
마. 임상시험 계획서 준수
1) 시험자는 의뢰자와 서면합의하고 심사위원회 및 식품의약품안전처장의 승인을 받은 임상시험 계획서를 준수하여 임상시험을 실시하여야 한다.
2) 시험책임자는 의뢰자와의 사전 합의와 심사위원회 및 식품의약품안전처장의 변경승인을 받기 전에는 임상시험 계획서와 다르게 임상시험을 실시해서는 안 된다. 다만, 제5호나목3)아) 단서에 해당하는 경우는 그러하지 아니하다.
3) 시험책임자 또는 시험담당자는 승인된 임상시험 계획서와 다르게 실시된 모든 사항 및 그 사유를 기록하여야 한다.
4) 시험책임자는 2) 단서에 따라 대상자에게 발생한 즉각적 위험 요소를 제거하기 위하여 시험책임자가 변경계획서에 대한 사전 승인 이전에 시행한 변경사항에 대하여 가능하면 빨리 해당 사실 및 실시 사유를 기록한 문서와 변경계획서를 의뢰자, 심사위원회 및 식품의약품안전처장에게 제출하여 각각 합의 및 승인을 받아야 한다.
[별표4] KGCP 제7호자목
자. 기록 및 보고
1) 시험책임자는 의뢰자에게 보고하는 증례기록서나 그 밖의 모든 보고서에 포함된 자료가 정확하고, 완결되며, 읽기 쉽고, 시기적절하도록 하여야 한다.
2) 근거문서를 근거로 한 증례기록서상의 자료는 근거문서와 일치하여야 하며, 일치하지 않는 내용에 대해서는 설명이 첨부되어야 한다.
[별표4] KGCP 제7호바목
바. 임상시험용 의약품의 관리
7) 관리약사등은 각각의 대상자에게 임상시험용 의약품의 정확한 투여방법을 설명하여야 하고, 대상자가 해당 지시 사항을 적절히 이행하고 있는지 확인하여야 한다.
'식약처 정보공개 > 실태조사 결과정보' 카테고리의 다른 글
| (품목) ㈜녹십자, 헌터라제 (0) | 2024.06.25 |
|---|---|
| (정기) 계명대학교동산병원 (0) | 2024.06.24 |
| (정기) 인산의료재단 메트로병원 (0) | 2024.06.24 |
| (정기) 학교법인울산공업학원 울산대학교병원 (0) | 2024.06.24 |
| (정기) 영남대학교병원 (0) | 2024.06.24 |




댓글