(정기) 서울특별시 서울의료원
임상시험실태조사 결과정보 리스트(2023.1.1 실태조사부터 공개 시작)

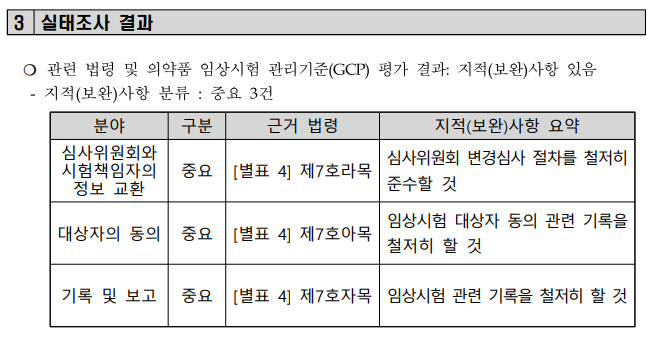
실태조사 결과

관련 법령
[별표 4] KGCP 제7호라목
라. 심사위원회와 시험책임자의 정보 교환
1) 임상시험을 실시하기 전에 시험책임자는 임상시험 계획서, 동의서(변경된 동의서를 포함한다), 대상자 확보방법(광고 등을 포함한다) 및 시험대상자설명서 등 그 밖에 대상자에게 문서 형태로 제공되는 각종 정보에 대하여 심사위원회의 심사를 받아야 하며, 시험책임자는 해당 임상시험의 실시가 승인된 경우(시정승인 또는 보완 후 승인된 경우를 포함한다) 심사통보서의 내용을 의뢰자에게 제공하여야 한다.
2) 임상시험 계획서에 대한 심사위원회의 승인을 받으려는 시험책임자는 심사위원회에 최신의 임상시험자 자료집 사본을 제출하여야 하며, 해당 임상시험 도중에 임상시험자 자료집이 개정된 경우에는 그 개정된 임상시험자 자료집 사본을 제출하여야 한다.
3) 시험책임자는 임상시험 실시 전에 다음의 문서를 심사위원회에 제출하고 심사위원회의 검토를 받아야 한다.
가) 임상시험 계획서(변경계획서를 포함한다)
나) 대상자 서면동의서 서식
다) 대상자에게 제공되는 서면 정보(시험대상자설명서를 포함한다)
라) 대상자 모집절차(광고 등을 포함한다)
마) 임상시험자 자료집
바) 안전성 정보
사) 대상자에게 제공되는 배상 또는 보상에 관한 정보(건강상 피해의 배상ㆍ보상을 위한 보험 가입 서류를 포함한다)
아) 시험책임자의 이력 및 경력
4) 5) 생략
6) 시험책임자는 1)에 따라 심사위원회의 심사를 받은 사항을 변경하려면 제5호나목3)에서 정한 표준작업지침서에 따라 심사위원회의 변경심사를 받아야 한다.
[별표 4] KGCP 제7호아목
아. 대상자의 동의
2) 대상자의 동의에 영향을 줄 수 있는 새로운 임상시험 관련 정보를 취득한 경우에는 동의서 서식, 시험대상자설명서, 그 밖의 문서화된 정보를 이에 따라 수정하고, 대상자에게 해당 서식 및 문서를 제공하기 전에 심사위원회의 승인을 받아야 한다. 이 경우 시험책임자는 제때 대상자 또는 대상자의 대리인에게 이를 알리고, 고지 대상자, 고지 일시 및 고지 내용을 기록하여야 한다.
8) 대상자의 임상시험 참여 전에 대상자 또는 대상자의 대리인과 동의를 받은 시험책임자 또는 시험책임자의 위임을 받은 의사, 치과의사, 한의사는 동의서에 서명하고, 해당 날짜를 자필로 적어야 한다.
9) 대상자 또는 대상자의 대리인이 동의서 서식, 시험대상자설명서, 그 밖의 문서화된 정보를 읽을 수 없는 경우에는 참관인이 동의를 받는 모든 과정에 참석하여야 한다. 이 경우 시험책임자 또는 시험책임자의 위임을 받은 자는 동의서 서식, 시험대상자설명서, 그 밖의 문서화된 정보를 대상자 또는 대상자의 대리인에게 읽어 주고 설명하여야 하며, 대상자 또는 대상자의 대리인은 대상자의 임상시험 참여를 말로 동의하고 가능하면 동의서에 자필로 서명하고 해당 날짜를 적고, 참관인이 동의서에 자필로 서명하고 해당 날짜를 적어야 한다. 이 경우 참관인은 동의서에 서명하기 전에 다음 사항을 확인하여야 한다.
가) 동의서와 시험대상자설명서, 그 밖의 문서화된 정보가 정확하게
대상자나 대상자의 대리인에게 설명되었는지 여부
나) 대상자나 대상자의 대리인이 해당 사실을 이해하였는지 여부
다) 동의를 받는 과정이 대상자나 대상자의 대리인의 자유의사에 따라 진행되었는지 여부
12) 제30조제1항제4호 단서에 따라 대상자의 이해능력ㆍ의사표현능력의 결여 등으로 대리인의 동의를 받아야 대상자의 임상시험 참여가 가능한 치료적 또는 비치료적 임상시험의 경우, 시험책임자 및 시험담당자는 대상자에게 대상자 자신이 이해할 수 있는 정도까지 임상시험에 관한 정보를 주어야 하며, 가능하면 대상자는 동의서에 자필로 서명하고 날짜를 적도록 하여야 한다.
[별표 4] KGCP 제7호자목
자. 기록 및 보고
1) 시험책임자는 의뢰자에게 보고하는 증례기록서나 그 밖의 모든 보고서에 포함된 자료가 정확하고, 완결되며, 읽기 쉽고, 시기적절하도록 하여야 한다.
2) 근거문서를 근거로 한 증례기록서상의 자료는 근거문서와 일치하여야 하며, 일치하지 않는 내용에 대해서는 설명이 첨부되어야 한다.
3) 의뢰자는 시험책임자나 시험책임자의 위임을 받은 자에게 증례기록서의 변경 또는 정정에 관한 지침을 주어야 하며, 모니터요원 등 의뢰자의 위임을 받은 자가 증례기록서를 변경 또는 정정을 하여야 할 상황, 수정사항의 기록방법 및 사후에 시험책임자의 확인을 받는 절차 등에 관한 지침을 마련하여야 한다.
4) 문서화 또는 전자화된 증례기록서의 내용을 변경하거나 정정하는 자는 의뢰자가 작성한 수정 지침에 따라 원래의 내용을 알아볼 수 있도록 수정하고, 수정일 및 수정 이유를 적고 서명하여야 한다.
5) 시험책임자는 3)에 따른 변경이나 정정사항 등에 관한 기록을 보관하여야 한다.
6) 시험책임자는 기본문서와 이 기준 및 관계 법령에 따라 작성된 임상시험 관련 문서(전자문서를 포함한다)를 제9호 및 관계 법령에 따라 보관하여야 한다. 다만, 결과보고서 작성을 마친 후에는 이들 문서를 제5호나목8)에 따른 보관책임자에게 인계하여야 한다.
7) 제8호머목2)에 따른 모니터요원, 제8호버목에 따라 점검을 실시하는 사람, 심사위원회 또는 식품의약품안전처장이 임상시험 관련 문서(전자문서를 포함한다)에 대한 열람을 요청한 경우에는 시험책임자 또는 임상시험실시기관의 장은 이에 적극 협조하여야 한다.
'식약처 정보공개 > 실태조사 결과정보' 카테고리의 다른 글
| (정기) 학교법인울산공업학원 울산대학교병원 (0) | 2024.06.24 |
|---|---|
| (정기) 영남대학교병원 (0) | 2024.06.24 |
| (정기) 노원을지대학교병원 (0) | 2024.06.21 |
| (품목) 안국약품㈜, 페바로젯정4/10밀리그램(피타바스타틴칼슘/에제티미브) 등 2품목- 실시기관 (0) | 2024.06.21 |
| (품목) 안국약품㈜, 페바로젯정4/10밀리그램(피타바스타틴칼슘/에제티미브) 등 2품목- 의뢰자 (0) | 2024.06.21 |




댓글